产品货号:
WH0104
中文名称:
Real-Time PCR预混液(探针法)
英文名称:
2×SuperReal Probe PCR Mix
产品规格:
125T|500T|5000T
发货周期:
1~3天
产品价格:
询价
Real-Time PCR预混液(探针法)是进行探针法Real-Time PCR的专用试剂,为2×浓度的预混反应液形式,使用十分简单方便。2×SuperReal Probe PCR Mix采用了独特的双组分热启动DNA聚合酶(化学修饰的HotStar Taq DNA聚合酶和抗体修饰的Anti Taq DNA聚合酶),配合精心优化buffer体系,具有定量准确,扩增效率高,重复性好和宽广的可信范围的特点。采用SYBR Green I嵌合荧光法进行Real-Time PCR时,建议使用Real-Time PCR预混液(染料法)。

- 2×SuperReal Probe PCR Mix采用了独特的双组分热启动DNA聚合酶(化学修饰的HotStar Taq DNA聚合酶和抗体修饰的Anti Taq DNA聚合酶),从而构成酶活自动调节系统,配合精心优化的buffer体系,具有定量准确,扩增效率高,重复性好和宽广的可信范围的特点。
- 本制品经过优化使荧光信号的释放达到优良的效果,同时充分降解了探针荧光淬灭基团的信号释放,用相同量的模板将得到更强的信号。
- 本制品为2×浓度的反应预混液形式,PCR反应液配制时,只需加入模板、引物、灭菌蒸馏水便可进行Real-Time PCR反应,操作简单方便。
- 本制品附带ROX Reference Dye,用于消除信号本底以及校正孔与孔之间产生的荧光信号误差,方便客户针对不同型号荧光定量PCR仪时选择对应浓度使用。

本制品采用了独特的双组分热启动DNA聚合酶进行PCR扩增,通过在PCR反应液中加入荧光探针,然后检测反应进程中的荧光强度,达到检测PCR产物扩增量的目的。
- 本制品中双热启动酶构成了独特的酶活自动调节系统。酶活自动调节系统是由化学修饰的HotStar Taq DNA聚合酶和抗体修饰的Anti Taq DNA聚合酶组成。其中HotStar Taq DNA聚合酶占绝大部分比例,其聚合酶活性的激活是严格依赖于95℃高温的一个缓释过程,而Anti Taq DNA聚合酶则在95℃高温下完全激活。经过95℃条件下孵育15min激活大部分HotStar Taq DNA聚合酶,进入PCR循环后,每经过一轮95℃条件下变性,即可重新激活一部分HotStar Taq DNA聚合酶。HotStar Taq DNA聚合酶独特的酶活缓释机制使其可以与Anti Taq DNA聚合酶构成独特的酶活自动调节系统。PCR反应初期,完全激活的Anti Taq DNA聚合酶可以协同已经激活的HotStar Taq DNA聚合酶达到优化的酶活状态,而在整个PCR反应过程中,每一轮新释放的HotStart Taq DNA聚合酶活力刚好可以弥补因热变性所导致的部分酶活损失。因此,2×SuperReal Probe PCR Mix在整个PCR反应过程始终保持优良的DNA聚合酶活力,配合精心优化Buffer体系,从而具有定量准确,扩增效率高,重复性好和宽广的可信范围的特点。
- 本制品经过优化特别有利于Taq酶发挥其5'-3'外切酶活性,使荧光信号的释放达到优良的效果。此外,2×SuperReal Probe PCR Mix也充分降解了探针荧光淬灭基团的信号释放,经过上述优化。用相同量的模板将得到更强的信号。

| 组分 | 125T | 500T | 5000T |
| 2×SuperReal Probe PCR Mix | 1.25mL | 4×1.25mL | 40×1.25mL |
| 50×ROX Reference Dye | 250μL | 1mL | 10×1mL |
| RNase-Free ddH2O | 2×1mL | 5×1mL | 50×1mL |
保存:-20℃,避免反复冻融,有效期1年。

收到本制品后,请立即置于-30~-15℃保存。从-30~-15℃取出使用时,将冻存的2×SuperReal Probe PCR Mix和50×ROX Reference Dye融解,然后轻轻颠倒混匀,待溶液完全均一后再行使用。如解冻后没有使用,须彻底混匀后重新冷冻。(在解冻过程中盐会出现分层现象,未混匀进行冷冻,盐晶体的析出将会对酶造成损害)。如需一段时间内经常取用,可在2~8℃条件下储存3个月。避免反复多次冻融。

- PCR反应的预变性条件必须设定为95℃ 15min,用以激活热启动酶。
- 如果试剂没有混匀,其反应性能会有所下降。使用时请上下颠倒轻轻混匀,请不要使用振荡器进行混匀,尽量避免出现泡沫,并经瞬时离心后使用。
- 本制品中不含有荧光探针等。
- 引物终浓度为300 nM,探针终浓度为200 nM可以在大多数体系中获得良好的扩增结果。需要进一步优化引物浓度的,可以在50~900 nM范围内调整;需要进一步优化探针浓度的,可以在100~500 nM范围内调整。
- 20μL反应体系中,基因组DNA或cDNA模板的使用量一般小于100ng,逆转录产物作为模板时,使用量应不超过PCR体系终体积的20%。

- 建立Real-Time PCR反应体系:
- 融解2×SuperReal Probe PCR Mix(如果保存在-30~-15℃)、50×ROX Reference Dye、模板、引物和RNase-Free ddH2O,并将所有试剂在室温下平衡并彻底混匀。
- 建议置于冰上进行Real-Time PCR反应液的配制。
成分 50μL体系 25μL体系 20μL体系 终浓度 2×SuperReal Probe PCR Mix 25μL 12.5μL 10μL 1× 正向引物(10μM) 1.5μL 0.75μL 0.6μL 300nM 正向引物(10μM) 1.5μL 0.75μL 0.6μL 300nM 荧光探针(10μM) 1μL 0.5μL 0.4μL 200nM DNA模板 - - - ≤200ng 50×ROX Reference Dye - - - - RNase-Free ddH2O 至50μL 至25μL 20μL - - 引物终浓度为300 nM可以在大多数体系中获得良好的扩增结果。扩增效率不高时,可增加PCR反应体系中的引物浓度;发生非特异扩增时,可适当减少PCR反应体系中的引物浓度。需要进一步优化引物浓度的,可以在50~900 nM范围内调整。
- 探针的浓度与使用的Real-Time PCR扩增仪、探针种类、荧光标记物质种类有关,实际使用时请参照仪器说明书,或各荧光探针的具体使用说明进行。通常探针终浓度为200nM可以在大多数体系中获得良好的扩增结果。需要进一步优化探针浓度的,可以在100~500nM范围内调整。
- 几种常见仪器的匹配ROX Reference Dye浓度见下表:
仪器 终浓度 ABI PRISM 7000/7300/7700/7900HT/Step One等 2.5×(例如2.5μL ROX/50μL体系) ABI 7500、7500 Fast;
Stratagene Mx3000P、Mx3005P和Mx4000等0.5×(例如0.5μL ROX/50μL体系) Roche仪器,Bio-Rad仪器,Eppendorf仪器等 不用添加
- 引物终浓度为300 nM可以在大多数体系中获得良好的扩增结果。扩增效率不高时,可增加PCR反应体系中的引物浓度;发生非特异扩增时,可适当减少PCR反应体系中的引物浓度。需要进一步优化引物浓度的,可以在50~900 nM范围内调整。
- 融解2×SuperReal Probe PCR Mix(如果保存在-30~-15℃)、50×ROX Reference Dye、模板、引物和RNase-Free ddH2O,并将所有试剂在室温下平衡并彻底混匀。
- 进行Real-Time PCR反应:
- 建议采用两步法PCR程序进行反应。变性时间可在1~3sec范围内进行调整,退火/延伸时间可在20~32sec范围内进行调整。
阶段 循环 温度 时间 内容 荧光信号采集 预变性 1× 95℃ 15min 预变性 否 PCR反应 40× 95℃ 3sec 变性 否 60℃ 20~32sec 退火/延伸 是 - 使用不同型号仪器进行时间设定时,请按照仪器使用说明书要求进行实验操作,使用ABI 7900HT/7900HT Fast/ViiA 7/StepOne/StepOnePlus时可设定为1sec。
- 使用不同型号仪器进行时间设定时,请按照仪器使用说明书要求进行实验操作,几种常见仪器的时间设定见下表:
使用ABI 7500 Fast/7900HT/7900HT Fast/ViiA 7/StepOne/StepOnePlus时请设定在30sec。 使用Roche LightCycler/LightCycler 480时请设定在20sec。 使用ABI 7000和7300时请设定在31sec。 使用ABI7500时请设定在32sec。
- 使用不同型号仪器进行时间设定时,请按照仪器使用说明书要求进行实验操作,使用ABI 7900HT/7900HT Fast/ViiA 7/StepOne/StepOnePlus时可设定为1sec。
- 盖上反应管,轻柔混匀。可短暂离心,确保所有组分均在管底。
- 将反应体系置于荧光定量PCR仪中,开始反应。
- 建议采用两步法PCR程序进行反应。变性时间可在1~3sec范围内进行调整,退火/延伸时间可在20~32sec范围内进行调整。

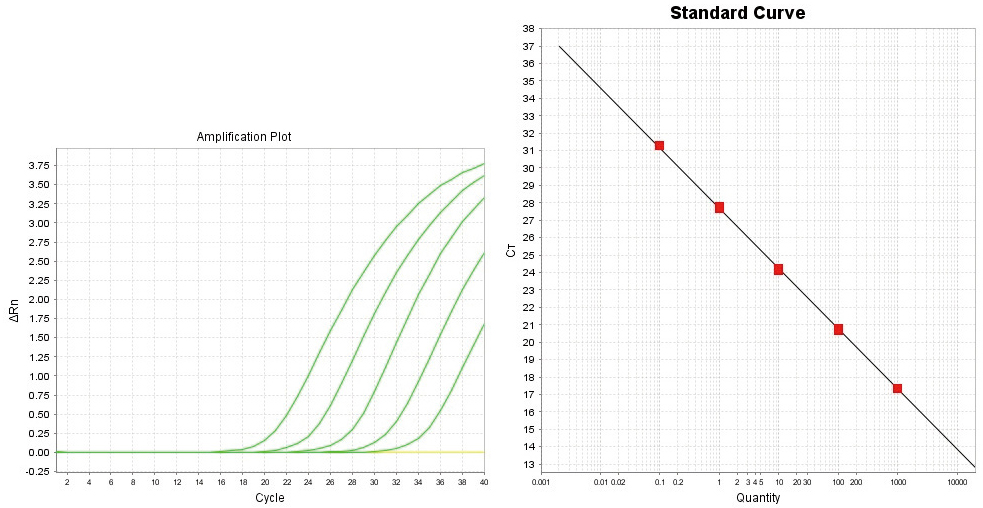
使用Applied Biosystems 7500 Fast Real-time PCR System
通过Real-time RT-PCR对Human GAPDH mRNA进行检出。
使用2×SuperReal Probe PCR Mix,cDNA量相当于Total RNA 1pg~10ng。Negative Control以ddH2O做为模板。

进行Real-time PCR反应时,PCR引物的设计非常重要。设计PCR扩增效率高,反应特异性强的引物可以参考以下要求。
| 引物长度 | 18~30个碱基 |
| GC含量 | 40~60% |
| Tm值 | 引物软件都可以给出Tm,与引物长度,碱基组成,引物使用缓冲的离子强度也有关。 上下游引物的Tm值要尽量接近。 简单的Tm计算公式为:Tm = 4℃(G + C)+ 2℃(A + T)。 一般采用较引物Tm值低5℃作为PCR退火温度。 提高退火温度可以增加PCR反应的特异性。 |
| 引物及PCR 扩增产物序列 | PCR扩增产物长度适宜在100~150bp之间。 尽量避开在模板的二级结构区域设计引物。 避免上下游引物3'端之间形成2个或以上的互补碱基以减少引物二聚体的形成。 引物3'端碱基不能有多于3个连续的G或C。 引物自身不应存在互补序列,否则引物自身会折叠成发夹状结构。 避免引物3'末端碱基为T。 引物序列中A、T、G、C要尽量均匀分布。 |

请准备适用于目的基因序列的荧光probe。Probe序列的设计请参考各Probe的设计指导。
另外,请尽可能使用HPLC级别以上纯化的Probe,否则残留的未结合的荧光染料会造成基线上飘从而降低检测的灵敏度。

进行RT-PCR反应时的操作方法
进行RT-PCR反应时,有三种cDNA第一链合成试剂盒可以选择,分别是反转录试剂盒,cDNA第一链合成反应预混液和cDNA第一链合成试剂盒。反转录试剂盒可3min去除基因组DNA的残留,使基因定量结果更加真实可信,适用于模板量为50ng~2μg的总RNA的快速反转录(共需21min),是荧光定量PCR的反转录实验的优秀选择。
- 将模板RNA在冰上解冻;5×gDNA Buffer、FQ-RT Primer Mix、10×King RT Buffer、RNase-Free ddH2O在室温(15~30℃)解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心以收集残留在管壁的液体。
- 以下操作步骤请在冰上进行。为了保证反应液配制的准确性,进行各项反应时,应先配制成Mix,然后再分装到每个反应管中。
- 按照表1的基因组DNA的去除体系配制混合液,彻底混匀。简短离心,并置于42℃,孵育3min。然后置于冰上放置。
表1.gDNA去除反应体系成分 用量 5×gDNA Buffer 2μL Total RNA - RNase-Free ddH2O 至10μL - 按照表2的反转录反应体系配制混合液。
表2.反转录反应体系成分 用量 10×King Fast RT Buffer 2μL Quicking RT Enzyme Mix 1μL FQ-RT Primer Mix 2μL RNase-Free ddH2O 至10μL - 将反转录反应中的Mix加到gDNA去除步骤的反应液中,充分混匀。
- 反转录反应条件如下:
42℃,孵育15min
95℃,孵育3min - PCR反应

- 低浓度模板时扩增曲线混乱,荧光强度变弱
原因 解决办法 目标DNA的拷贝数过少 反应液中的目标DNA拷贝数只有几倍到几十倍时,拷贝数散乱的概率变大,容易形成线性混乱。请适当提高样品浓度再进行反应。 与引物二聚体发生竞争 目的片段扩增的同时出现引物二聚体的扩增,由于竞争使目的片段的扩增反应变弱。请摸索反应条件或重新设计引物,以防止引物二聚体的形成。 DNA被反应离心管吸附而损失 模板浓度较低或样品稀释后长时间存放时,会导致DNA被反应离心管吸附而损失。请提高样品浓度再进行反应。如果对样品进行稀释,建议稀释后立即进行反应。 - NTC可见扩增
原因 解决办法 发生交叉污染 请更换新的试剂或灭菌水。仍无法得到改善时,请尝试到新的实验环境进行操作。 仪器设定误差(进行多重PCR时等) 当使用几种荧光探针时,请正确设定荧光测定,防止出现因不同染料的光谱交叉而导致的检测信号差异。 - 定量值重现性差
原因 解决办法 仪器方面的故障 因为仪器的不适用,在温度管理或检测时产生重现性差。请根据相应仪器的说明书进行点检。 样品纯度不好 不纯的样品会导致实验的重现性差。 稀释的模板放置太久 浓度较低的DNA溶液存放时间较长时,由于被管壁吸附从而实际浓度会更低,建议从原液重新稀释后再进行反应。另外,通过梯度稀释的标准样品最好每次使用时直接从原液稀释。 引物或探针质量下降 尽量避免新合成引物批次间的差异,可以使用原来质量好的引物做为对照。 PCR反应条件、引物浓度、序列等不恰当 扩增效率差的PCR较容易产生重现性差。通过变更引物和探针的浓度或PCR反应条件来进行调整。扩增不好时,一般可降低退火温度或提高引物浓度,也可以延长延伸时间。如模板的GC含量较高,可延长变性时间。仍得不到改善时,建议重新设计引物和探针。 计量误差 反应体积太小会导致检测精度下降。请根据定量PCR仪推荐的反应体积重新实验。 - 扩增效率低于90%(slope<-3.6)
原因 解决办法 引物质量不好 当引物质量不好时,会导致扩增效率大幅下降。可从引物原液重新稀释,或重新合成引物。 计算扩增效率时未排除偏离直线的Ct值 计算扩增效率时包含了偏离直线的Ct值,增大了计算值的误差。应将偏离直线的Ct值排除后再计算。 反应条件不合适 请优化引物,探针浓度及PCR反应条件。 - 扩增效率高于110%(slope>-3.1)
原因 解决办法 计算扩增效率时未排除偏离直线的Ct值 计算扩增效率时包含了偏离直线的Ct值,增大了计算值的误差。应将偏离直线的Ct值排除后再计算。 样品中的杂质对高浓度模板抑制明显 当样品含有杂质时,对高浓度模板抑制明显,从而增大了扩增效率。请降低样品浓度,或进一步纯化模板。 - 扩增曲线荧光信号很弱,或扩增曲线呈锯齿状
原因 解决办法 检测光光谱设定误差 由于目前不同荧光定量PCR仪的原理和提供的检测光光谱范围的差异,因此在选择探针的发光基团和淬灭基团时一定要根据所用的仪器型号设置的可检测的荧光信号范围内选择。请参照仪器的使用说明书,重新确定参数设置。 荧光探针纯度太低 请使用HPLC级别以上纯化的Probe,否则残留的未结合的荧光染料会造成基线上飘,从而导致扩增产物所产生的荧光值变低。 荧光探针质量较差 由于探针保存中分解导致基线上飘,从而导致扩增产物所产生的荧光值变低。此外,一部分荧光染料不适合含有EDTA的buffer进行保存。请按照Probe合成公司推荐的保存条件。 荧光采集时间太短 对部分仪器,需要更长的延伸时间来充分采集荧光。扩增曲线锯齿状较明显时,将延伸时间设定为45~60sec可得到改善。
相关搜索:Real-Time PCR预混液(探针法),qPCR预混液,qPCR反应预混液,qPCR预混反应液,荧光定量PCR,探针法,Real-Time PCR,qPCR扩增,qPCR mix,2×SuperReal Probe PCR Mix



